ایٹمز کی ساخت اور ان کی کیمیائی خصوصیات کا انحصار ان کے الیکٹرانک کنفیگریشن پر ہوتا ہے۔ ایٹمز Octet Rule کی پیروی کرتے ہیں، جو کہ ایک بنیادی اصول ہے جو بیان کرتا ہے کہ ایٹمز اپنے بیرونی الیکٹران شیل میں آٹھ الیکٹران رکھنے کی کوشش کرتے ہیں۔ اس اصول کی بنیاد پر ایٹمز اپنی استحکام کو بڑھانے کے لیے دیگر ایٹمز کے ساتھ کیمیائی بندھن بناتے ہیں۔
جب ایٹمز آٹھ الیکٹرانز کی تشکیل کے لیے ایک دوسرے کے ساتھ تعامل کرتے ہیں تو وہ مختلف کیمیائی ردعمل کا مظاہرہ کرتے ہیں۔ ان تعاملات میں کوئلیشن، آئیونک اور کیوئلینٹ بندھن شامل ہوتے ہیں جو کہ ان کی ایٹمی پروفائل کو متاثر کرتے ہیں۔ اس طرح یہ اصول کیمیاء کی بنیادی تفہیم کا حصہ ہے اور ایٹمز کے بیچ کی تعاملات کی پیچیدگی کو سمجھنے میں مدد کرتا ہے۔
کیوں ایٹمز کو Octet Rule کی ضرورت ہے
ایٹمز کی کیمیا کی دنیا میں، *Octet Rule ایک بنیادی اصول ہے جو یہ بیان کرتا ہے کہ ایٹمز اپنی کنفیگریشن کو ایسے ترتیب دینے کی کوشش کرتے ہیں کہ ان کی بیرونی الیکٹرون شیل میں آٹھ الیکٹران ہوں۔ اس کے پیچھے کچھ اہم وجوہات ہیں جن کی بنا پر ایٹمز کو Octet Rule کی ضرورت ہوتی ہے۔
سب سے پہلے، آئیں دیکھتے ہیں کہ ایٹمز کیوں ایسی ترتیب چاہتے ہیں:
- استحکام: آٹھ الیکٹران کی موجودگی ایٹمز کی استحکام کو بڑھاتی ہے۔ ان کے پاس مکمل الیکٹرون شیل ہونے کی وجہ سے، وہ کیمیائی تعاملات میں کم ردعمل ظاہر کرتے ہیں۔
- توانائی کی کمی: جب ایٹمز کی بیرونی شیل میں آٹھ الیکٹران ہوتے ہیں، تو وہ توانائی کے نقطہ نظر سے کم مستحکم ہوتے ہیں۔ ایک مستحکم حالت ایٹمز کو اپنی شکل میں باقی رہنے کے لیے بهترین بناتی ہے۔
- کیمیائی بندش: Octet Rule کی پیروی کرنے والے ایٹمز اکثر کیمیائی بندش کے ذریعے ایک دوسرے کے ساتھ ملتے ہیں، تاکہ اپنے الیکٹران کی تعداد کو آٹھ تک پہنچا سکیں۔ یہ بندش مختلف قسم کی ہوتی ہیں، جیسے کہ آئیونک اور کوالینٹ بندشیں۔
مختلف اقسام کے ایٹمز، جیسے میٹلز اور نان میٹلز، Octet Rule کی پیروی کرکے اپنی اپنی مخصوص طریقوں سے سیکھتے ہیں۔ یہ طریقے ان کی سمتی شکل اور کیمیائی خصوصیتوں پر اثر انداز ہوتے ہیں۔
کبھی کبھار، کچھ ایٹمز جیسے ہیلیئم، ہیجین، اور لیتھیم Octet Rule کی حدوں سے باہر نکلتے ہیں۔ ان کے پاس کم یا زیادہ الیکٹران ہوتے ہیں، لیکن یہ انہیں دور تک لے جا سکتے ہیں۔ مثال کے طور پر، ہیلیئم کے پاس صرف دو الیکٹران ہیں، لیکن یہ پھر بھی اپنے مخصوص کیمیائی خواص کی بنا پر انتہائی مستحکم ہے۔
آخر میں، Octet Rule کا بنیادی مقصد ایٹمز کی کیمیائی استحکام کو بہتر بنانا اور کیمیائی تعاملات کو سمجھنے میں مدد کرنا ہے۔ یہ سمجھنا ضروری ہے کہ ایٹمز کیوں اور کیسے یہ اصول اپناتے ہیں تاکہ ہم کیمیاء کی اس خوبصورت دنیا کو مزید بہتر طریقے سے سمجھ سکیں۔
یہ بھی پڑھیں: Fibrocol Sachet کیا ہے اور اس کے استعمالات اور سائیڈ ایفیکٹس
Octet Rule کی مثالیں
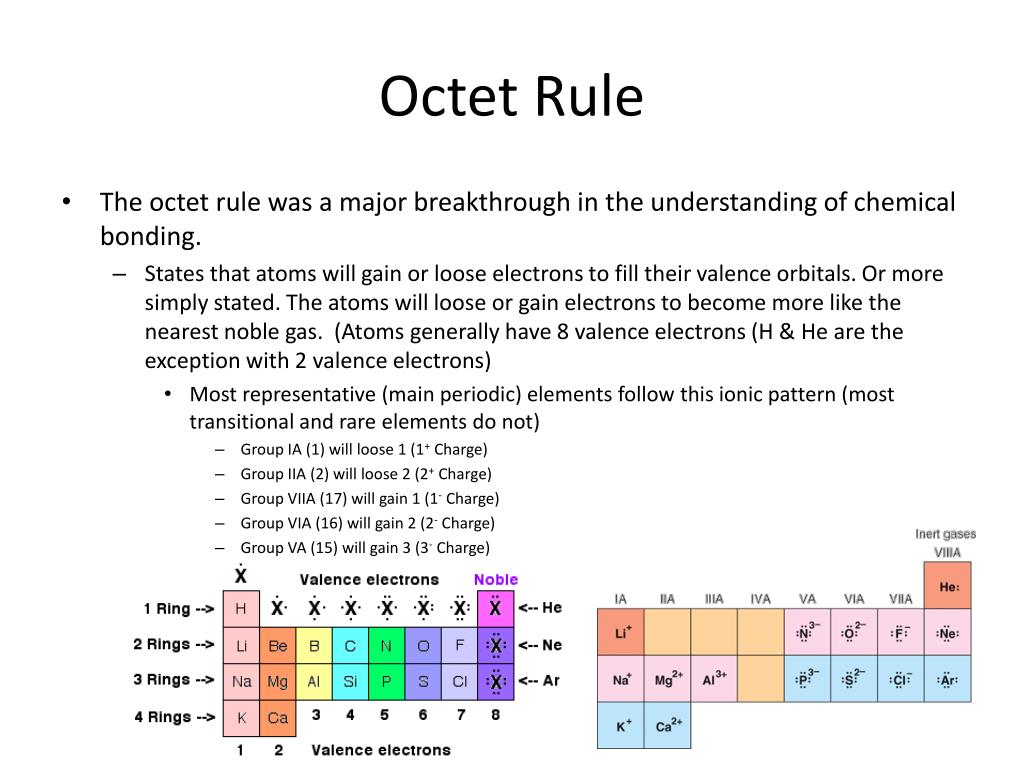
Octet Rule ایک اہم اصول ہے جو ایٹمز کی کیمیائی کمیونیکیشن کو سمجھنے میں مدد کرتا ہے۔ یہ اصول یہ بیان کرتا ہے کہ ایٹمز اپنی بیرونی الیکٹران شیل میں آٹھ الیکٹران حاصل کرنے کی کوشش کرتے ہیں، تاکہ وہ مستحکم بن سکیں۔ آئیے چند مثالوں کے ذریعے اس اصول کو سمجھتے ہیں:
1. نیوٹروجن (N)
نیوٹروجن کا ایٹمی نمبر 7 ہے، اس کے پاس 5 بیرونی الیکٹران موجود ہیں۔ یہ ایٹم 3 مزید الیکٹران حاصل کرکے اپنی شیل کو مکمل کرنا چاہتا ہے۔ نیوٹروجن درمیانی جوڑوں (covalent bonds) کی مدد سے دیگر ایٹمز کے ساتھ ملتا ہے تاکہ وہ اپنی ضرورت کی تکمیل کر سکے۔
2. آکسیجن (O)
آکسیجن کی ایٹمی تعداد 8 ہے اور اس کی بیرونی شیل میں 6 الیکٹران ہوتے ہیں۔ آکسیجن 2 مزید الیکٹران حاصل کرنے کی کوشش کرتی ہے، جو کہ عموماً 2 ہائیڈروجن ایٹمز کے ساتھ مل کر پانی (H2O) بناتی ہے۔ یہ مثال Octet Rule کی عمدہ وضاحت کرتی ہے۔
3. نایٹروجن کھورات (Noble Gases)
نایٹروجن کھورات جیسے ہیلیئم (He)، نیون (Ne)، اور آرگن (Ar) کیمیائی طور پر غیرفعال ہیں کیونکہ ان کے پاس اپنی بیرونی شیل میں آٹھ الیکٹران ہیں۔ یہ ایٹمز کبھی بھی دیگر ایٹمز کے ساتھ ملنے کی ضرورت محسوس نہیں کرتے، کیونکہ وہ پہلے ہی مستحکم ہیں۔
4. سٹرونٹیم (Sr)
سٹرونٹیم، جس کا ایٹمی نمبر 38 ہے، اپنی دو بیرونی الیکٹرانز کو چھوڑ کر آٹھ الیکٹرانز حاصل کرنے کی کوشش کرتا ہے۔ یہ اصول کے تحت ایک آزاد اینورالی (ion) بناتا ہے جو کہ سٹرونٹیم آئون (Sr2+) کہلاتا ہے۔
5. کلورین (Cl)
کلورین کا ایٹمی نمبر 17 ہے، اور اس کے پاس باہر 7 الیکٹران موجود ہیں۔ یہ ایک الیکٹران حاصل کرکے آٹھ کا ہدف حاصل کرنے کی کوشش کرتی ہے۔ یہ سادہ طریقے سے سوڈیم (Na) کے ساتھ مل کر سوڈیم کلورائیڈ (NaCl) بناتی ہے۔
یہ چند مثالیں ہمیں بتاتی ہیں کہ Octet Rule کس طرح مختلف ایٹمز کے ساتھ تعامل کرنے میں مدد دیتی ہے۔ یہ قواعد بنیادی کیمیائی تعاملات کو سمجھنے میں بنیادی کردار ادا کرتے ہیں۔
یہ بھی پڑھیں: سبز الائچی کے فوائد اور استعمالات اردو میں
Octet Rule کے فوائد
Octet Rule، یعنی آکٹٹ اصول، ایٹمز کے درمیان کیمیائی تعاملات کی وضاحت کرنے والا ایک اہم نظریہ ہے۔ اس اصول کے تحت، ایٹمز مستحکم حالت میں آنے کے لیے اپنے بیرونی الیکٹران شیل میں آٹھ الیکٹران مکمل کرنے کی کوشش کرتے ہیں۔ آئیے دیکھیں کہ اس اصول کے فوائد کیا ہیں:
- استحکام میں اضافہ: Octet Rule کی پیروی کرنے والے ایٹمز عام طور پر زیادہ مستحکم ہوتے ہیں۔ جب ایٹمز اپنے بیرونی شیل میں آٹھ الیکٹران حاصل کر لیتے ہیں تو وہ کیمیائی تعاملات کے دوران کم ردعمل دیتے ہیں، جو کہ انہیں زیادہ محفوظ بناتا ہے۔
- کیمیائی بندش کی وضاحت: یہ اصول کیمیائی بندوں جیسے کہ آئیونک اور کویلنٹ بندشوں کی وضاحت کرتا ہے۔ جب ایٹمز میں سے ایک الیکٹران دے دیتا ہے تو یہ آئنز بناتا ہے، اور آیونک بندش میں مدد ملتی ہے۔
- اینرگی کی بچت: اگر ایٹمز آکٹٹ Rule کی پیروی کرتے ہیں تو اس سے توانائی کی بچت ہوتی ہے۔ ایٹمز کو کم توانائی میں مستحکم حالت میں پہنچنے کا موقع ملتا ہے، جس سے ان کے اندر کیمیائی توانائی میں کمی آتی ہے۔
- کیمیائی عناصر کا گروہ بندی: اس اصول کی بنیاد پر مختلف کیمیائی عناصر کی درجہ بندی کی جاتی ہے۔ یہ ہمیں عناصر کی کیمیائی خصوصیات اور ان کی تعاملات کو سمجھنے میں مدد دیتا ہے۔
- ایٹمی تعاملات کی پیشگوئی: Octet Rule کی مدد سے ہم مختلف ایٹمز کے درمیان ہونے والے تعاملات کی پیشگوئی کر سکتے ہیں۔ یہ ہمیں کیمیائی تجربات میں درستگی فراہم کرتی ہے۔
نتیجہ کے طور پر، Octet Rule نہ صرف ایٹمز کی کیمیائی برتاؤ کو سمجھنے میں مددگار ہے، بلکہ یہ کیمیاء کی بنیادوں کو بھی مضبوط کرتا ہے۔ جب ہم اس اصول کو سمجھتے ہیں تو ہم سائنسی تجربات اور نئے مواد کی تخلیق کے عمل میں بہتر نتائج حاصل کر سکتے ہیں۔
ایٹمز کے باہمی تعامل اور Octet Rule
جب ہم ایٹمز کے باہمی تعامل کی بات کرتے ہیں تو ہمیں Octet Rule کے بارے میں جاننا ضروری ہے۔ یہ قاعدہ یہ بیان کرتا ہے کہ اکثر ایٹمز کی کوشش ہوتی ہے کہ وہ اپنی بیرونی ترین سطح پر آٹھ الیکٹرونز حاصل کریں۔ جب ایٹمز اس قاعدہ کی پیروی کرتے ہیں تو وہ زیادہ مستحکم ہو جاتے ہیں، جو کہ کیمیائی تعاملات میں ان کے رویے کو متاثر کرتا ہے۔
آئیے دیکھتے ہیں کہ ایٹمز Octet Rule کی پیروی کیسے کرتے ہیں:
- الیکٹران کی منتقلی: ایٹمز اپنے الیکٹرانز کو دوسروں کے ساتھ تبدیل کر کے Octet Rule کو حاصل کر سکتے ہیں۔ جیسے کہ سوڈیم (Na) اپنے ایک الیکٹران کو کلورین (Cl) کو دے دیتا ہے، جس سے دونوں ایٹمز مستحکم ہوتے ہیں۔
- کیمیائی بانڈنگ: جب ایٹمز کے درمیان کیمیائی بندش ہوتی ہے، تو وہ ایک دوسرے کے ساتھ مل کر اپنے الیکٹرانز کو شیئر کرتے ہیں۔ یہ عمل بھی Octet Rule کی پیروی کرتا ہے۔ مثلاً، کاربن اور آکسیجن کے درمیان بانڈنگ سے دونوں ایٹمز اپنے بیرونی الیکٹرونز کی تعداد میں اضافہ کرتے ہیں۔
- مستحکم گیسیں: نواباتی گیسیں جیسے ہیلیم (He) اور نیون (Ne) پہلے سے ہی مکمل دائرہ ایٹمز ہیں۔ ان کی Octet Rule کی پیروی انہیں انتہائی مستحکم بناتی ہے اور یہ دیگر ایٹمز کے ساتھ تعامل نہیں کرتے۔
یاد رہے کہ Octet Rule ہر ایٹم پر لاگو نہیں ہوتا، خاص طور پر جب ہم چھوٹے ایٹمز کی بات کرتے ہیں، جیسے ہائیڈروجن (H) یا ہیلیم (He)۔ ان کی ضروریات مختلف ہوسکتی ہیں۔
لہذا، Octet Rule* کا مطالعہ نہ صرف ہمیں ایٹمز کے تعاملات کی بنیادیات کو سمجھنے میں مدد دیتا ہے، بلکہ ہمیں یہ بھی سکھاتا ہے کہ کیسے ایٹمز اپنی کیمیائی خصوصیات کو بہتر بناتے ہیں۔ اس اصول کی مدد سے ہم ایٹمز کی مستحکم حالتوں کا تصور کر سکتے ہیں اور نئے مرکبات کی تشکیل کی وجوہات کو جان سکتے ہیں۔







