کسی مرکب کا Formula Mass معلوم کرنا ایک اہم عمل ہے، خاص طور پر کیمیا کی دنیا میں۔ یہ نہ صرف تجرباتی کام کے لیے بلکہ سائنسی تحقیق کے لیے بھی بنیادی حیثیت رکھتا ہے۔ Formula Mass کی صحیح سمجھ بوجھ رکھنے سے کیمیکلز اور ان کے خواص کو جاننے میں مدد ملتی ہے۔
کسی بھی مرکب کے Formula Mass کو حساب کرنے کے لیے مرکب میں موجود ایٹمز کی تعداد اور ان کے ایٹمی ماس کا حساب لینا ہوتا ہے۔ جب آپ ان تمام ایٹمز کی ایٹمی ماس کو جمع کرتے ہیں تو آپ کو مرکب کا مجموعی وزن ملتا ہے، جو کہ Formula Mass کہلاتا ہے۔
مرکب کی ترکیب کا تعین کرنا
کسی مرکب کی formula mass کا تعین کرنے کے لیے سب سے پہلے ہمیں اس مرکب کی *ترکیب یا نقصان کو سمجھنا ہوگا۔ مختلف عنصر اپنے علیحدہ علیحدہ ایٹمز کے ساتھ مرکب میں شامل ہوتے ہیں، جو بالآخر اس مرکب کی کل massa کا تعین کرتے ہیں۔
اس عمل کی آسان راہنمائی کے لیے، ہم درج ذیل نکات پر توجہ مرکوز کریں گے:
- مرحلہ 1: مرکب کی کیمیاوی ترکیب معلوم کریں۔
- مرحلہ 2: ہر عنصر کا ایٹمی وزن تلاش کریں۔
- مرحلہ 3: ہر عنصر کے ایٹمی وزن کو ان کے تعداد سے ضرب دیں۔
- مرحلہ 4: تمام عناصر کے مجموعی وزن کا حساب لگائیں۔
مثال کے طور پر، اگر ہمارے پاس H2O (پانی) کا مرکب ہے تو اس کی ترکیب یہ ہے:
- ہائڈروجن (H) کی تعداد: 2
- آکسیجن (O) کی تعداد: 1
اب ہم ہر عنصر کے ایٹمی وزن تلاش کرتے ہیں:
| عنصر | ایٹمی وزن (g/mol) | تعداد | اجمالی وزن (g/mol) |
|---|---|---|---|
| ہائڈروجن (H) | 1.01 | 2 | 2.02 |
| آکسیجن (O) | 16.00 | 1 | 16.00 |
| کل وزن | 18.02 |
دیکھیں! H2O کی formula mass عبارت ہے 18.02 g/mol، جو کہ ہائڈروجن اور آکسیجن کے ایٹمی وزن کے مجموعے کا نتیجہ ہے۔
یقیناً، مختلف مرکبات کی ترکیب کے لیے یہ طریقہ کار ہر مرکب کے لیے استعمال کیا جا سکتا ہے। یہ ایک بنیادی کام ہے جو کیمیاء میں ہمیشگی کے ساتھ انجام دیا جاتا ہے۔ اس سادہ سے انداز میں، آپ کسی بھی مرکب کی formula mass کو جلدی اور آسانی سے حساب لگا سکتے ہیں!
یہ بھی پڑھیں: Peptiban Syrup کے استعمال اور سائیڈ ایفیکٹس
اجزاء کے ایٹم کی تعداد معلوم کرنا
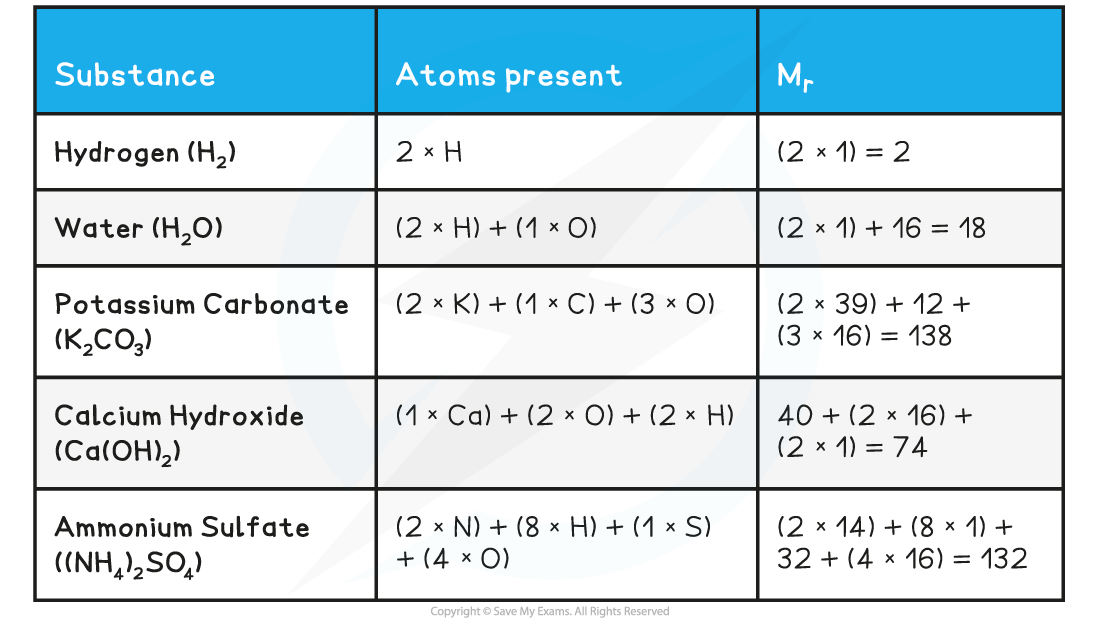
کسی مرکب کا Formula Mass معلوم کرنے کے لیے سب سے پہلے آپ کو اس مرکب میں موجود اجزاء کے ایٹمز کی تعداد جاننی ہوگی۔ یہ جاننا آپ کے لئے اہم ہے کیونکہ مختلف ایٹمز کی تعداد مختلف ماس فراہم کرتی ہے۔ آئیے، اس کا طریقہ کار جانتے ہیں:
1. مرکب کا Chemical Formula معلوم کریں:
آپ کو سب سے پہلے مرکب کا Chemical Formula معلوم کرنا ہوگا، مثلاً: H2O، NaCl، یا C6H12O6۔ اس فارمولے میں ہر ایک عنصر کے ایٹمز کی تعداد لکھی گئی ہوتی ہے۔
2. ایٹمز کی تعداد کی پہچان:
جب آپ Chemical Formula دیکھتے ہیں، تو ہر عنصر کے سامنے جو عدد لکھا ہوتا ہے، وہ اس عنصر کے ایٹمز کی تعداد بتاتا ہے۔ مثال کے طور پر:
- H2O میں H (ہائیڈروجن) کے 2 ایٹمز ہیں اور O (آکسیجن) کا 1 ایٹم ہیں۔
- NaCl میں Na (سوڈیم) کا 1 ایٹم ہے اور Cl (کلورین) کا بھی 1 ایٹم ہے۔
- C6H12O6 میں C (کاربن) کے 6 ایٹمز، H (ہائیڈروجن) کے 12 ایٹمز، اور O (آکسیجن) کے 6 ایٹمز ہیں۔
3. ایٹمز کو گننے کا طریقہ:
آپ کو ہر عنصر کے عدد کو دیکھ کر یہ معلوم کرنا ہوگا کہ مرکب میں کتنی نوعیت کے ایٹمز موجود ہیں:
| عنصر | ایٹمز کی تعداد |
|---|---|
| H | 2 |
| O | 1 |
اس طرح آپ ہر مرکب کے ایٹمز کی تعداد کو معلوم کر سکتے ہیں۔ ایک بار جب آپ نے ایٹمز کی تعداد اور ان کے صحیح قسم معلوم کر لئے، تو آپ مزید آگے بڑھ کر Formula Mass کی حساب کتاب کر سکتے ہیں۔
یاد رکھیں کہ اس عمل میں دقت ہو سکتی ہے لیکن تھوڑی سی مشق سے آپ اس میں مہارت حاصل کر سکتے ہیں!
یہ بھی پڑھیں: Reltus Syrup کے استعمال اور مضر اثرات
ایٹم کی ماس کا حساب کیسے کریں
ایٹم کی ماس کا حساب بہت ضروری ہے جب ہم کیمیکل کمپاؤنڈز یا ری ایکشنز کے بارے میں بات کرتے ہیں۔ لیکن سوال یہ ہے کہ ہم کسی ایٹم کی ماس کو کیسے جان سکتے ہیں؟ آئیے اس کے بارے میں تفصیل سے جانتے ہیں۔
ایٹم کی ماس کا حساب کرنے کے لئے ہمیں کچھ بنیادی معلومات کی ضرورت ہوتی ہے:
- ایٹمی ماس: ہر ایٹم کا ایک مخصوص ایٹمی ماس ہوتا ہے جو کہ اس کے نیوکلیس میں موجود پروٹون اور نیوٹران کی تعداد پر منحصر ہے۔
- ایٹسومیٹک سٹیٹ: ایٹم کی سٹیٹ ایٹمی ماس کو متاثر کر سکتی ہے، خاص طور پر جب کوئی ایٹم آئنائز ہوتا ہے۔
- مادہ کی مقدار: کسی ایٹم کی ماس کا حساب اس مقدار کو جاننے سے بھی متاثر ہوتا ہے۔
ایٹم کی ماس باقاعدہ طور پر کیسے جانیں:
- سب سے پہلے، اپنے ایٹم کا نام یا کیمیائی علامت معلوم کریں۔
- پھر، کسی معتبر جدول جیسے Periodic Table کا استعمال کریں جہاں ایٹمی ماس پہلے سے دیا گیا ہوتا ہے۔
- ہر ایٹم کے نیوکلیس میں موجود پروٹونز اور نیوٹرانز کی تعداد پر بھی غور کریں۔
ایٹمی ماس کو یوں لکھا جاتا ہے: A = Z + N، جہاں:
- A: ایٹمی ماس (پروٹونز اور نیوٹران کا مجموعہ)
- Z: عددی عدد (پروٹون کی تعداد)
- N: نیوٹران کی تعداد
مثال کے طور پر، اگر آپ ہائیڈروجن (H) ایٹم کا ایٹمی ماس جاننا چاہتے ہیں، تو آپ کو پتہ چلے گا کہ اس میں ایک پروٹون ہے اور کچھ ایٹمز نیوٹرانز رکھتے ہیں۔ تو اس کی ایٹمی ماس تقریباً 1.008 ہے۔
یاد رکھیں، جب آپ مختلف ایٹمز کے ماس کا حساب کریں گے تو آپ کو ہمیشہ C({}) کی کیمیائی علامت کو دھیان میں رکھنا ہوگا تاکہ آپ کے حسابات درست ہوں۔ اس طرح آپ آسانی سے مختلف ایٹمز کا ماس معلوم کر سکتے ہیں اور کیمیکل ری ایکشنز میں ان کا استعمال کر سکتے ہیں۔
یہ بھی پڑھیں: اسابگول کے فوائد اور سائیڈ ایفیکٹس اردو میں
حساب کرنے کا عمل
کسی مرکب کا Formula Mass معلوم کرنا ایک اہم اور دلچسپ عمل ہے۔ یہ نہ صرف کیمیا کی دنیا میں آپ کی مدد کرتا ہے بلکہ آپ کو مختلف مرکبات کے خواص کو سمجھنے میں بھی معاونت فراہم کرتا ہے۔ تو چلیے دیکھتے ہیں کہ ہم کسی مرکب کا Formula Mass کیسے calculate کر سکتے ہیں:
Step 1: عناصر کی شناخت کریں
سب سے پہلے، آپ کو مرکب میں موجود elements کی شناخت کرنی ہوگی۔ ہر عنصر کی کیمیائی علامت کو دیکھیں۔ مثلاً، پانی (H2O) میں ہائیڈروجن (H) اور آکسیجن (O) موجود ہیں۔
Step 2: ایٹم کی تعداد معلوم کریں
اب آپ کو یہ طے کرنا ہوگا کہ ہر عنصر کے کتنے ایٹم مرکب میں موجود ہیں۔ مثال کے طور پر، پانی میں:
- 2 ایٹم ہائیڈروجن کے
- 1 ایٹم آکسیجن کا
Step 3: ایٹم کے وزنوں کا استعمال کریں
ہر عنصر کے ایٹم کی atomic mass معلوم کریں۔ آپ کو یہ معلومات Periodic Table سے ملیں گی۔ مثال کے طور پر،
- ہائیڈروجن کا atomic mass تقریباً 1.01 g/mol ہے
- آکسیجن کا atomic mass تقریباً 16.00 g/mol ہے
Step 4: ایٹم کی تعداد اور atomic mass کو ضرب دیں
اب، آپ کو ہر عنصر کے ایٹم کی تعداد کو ان کے atomic mass سے ضرب دینا ہوگا:
- ہائیڈروجن: 2 × 1.01 = 2.02 g/mol
- آکسیجن: 1 × 16.00 = 16.00 g/mol
Step 5: تمام عناصر کے وزن کو جمع کریں
آخری مرحلے میں، آپ کو تمام عناصر کے وزن کو آپس میں جمع کرنا ہے:
2.02 g/mol (ہائیڈروجن) + 16.00 g/mol (آکسیجن) = 18.02 g/mol
نتیجہ: پانی کا Formula Mass* 18.02 g/mol ہے۔ یہ عمل دوسرے مرکبات کے لئے بھی اسی طرح سے کیا جا سکتا ہے۔ بس عناصر کی شناخت کریں، ایٹم کی تعداد، atomic mass معلوم کریں، اور پھر جمع کریں۔ یہ نہایت آسان اور دلچسپ ہوتا ہے!
مثال کے ساتھ وضاحت
کسی مرکب کا Formula Mass معلوم کرنا ایک اہم عمل ہے جو کیمسٹری میں بہت استعمال ہوتا ہے۔ آئیے ایک آسان مثال کے ذریعے اسے سمجھتے ہیں۔
لیجیے، ہم پانی (H2O) کا Formula Mass معلوم کرتے ہیں۔ پانی کے مرکب میں ایک جڑ کا ہونا ضروری ہے - اس کے عناصر ہائیڈروجن (H) اور آکسیجن (O) ہیں۔
1. عناصر کی شناخت کریں
پانی میں جڑے عناصر یہ ہیں:
- ہائیڈروجن (H)
- آکسیجن (O)
2. مختلف عناصر کے لئے Atomic Mass معلوم کریں
اب ہمیں ہر عنصر کے لئے atomic mass تلاش کرنے کی ضرورت ہے:
| عنصر | Atomic Mass (g/mol) |
|---|---|
| ہائیڈروجن (H) | 1.01 |
| آکسیجن (O) | 16.00 |
3. Formula Mass کا حساب لگائیں
اب ہم Formula Mass کا حساب لگانے کے لئے ہر عنصر کی atomic mass کو اس کے نمبروں سے ضرب دیتے ہیں:
- ہائیڈروجن: 2 × 1.01 = 2.02 g/mol
- آکسیجن: 1 × 16.00 = 16.00 g/mol
اب ان دونوں کو جمع کرتے ہیں:
Total = 2.02 + 16.00 = 18.02 g/mol
نتیجہ
لہذا، پانی کا Formula Mass 18.02 g/mol ہے۔ اسے جان کر آپ سمجھ گئے ہوں گے کہ کسی مرکب کا Formula Mass کیسے معلوم کیا جا سکتا ہے۔ یہ نہایت سادہ اور موثر طریقہ ہے، اور آپ کسی بھی مرکب کے لئے اسی طریقے کو اپناتے ہوئے حساب لگا سکتے ہیں۔
یاد رکھیے کہ مختلف عناصر کے atomic mass مختلف ہوتے ہیں، اس لیے ہمیشہ ان کی درست اعداد و شمار کی جانچ کریں تاکہ آپ کا حساب صحیح ہو۔







